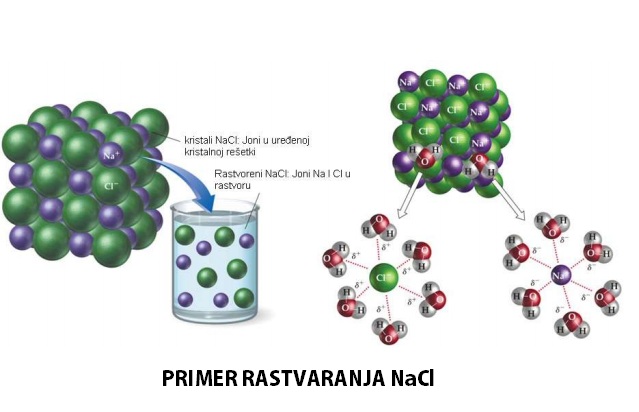
Vrsta koja mlade rađa kroz usta
 Rheobatrachus silus neobična je žaba koja je izumrla 1983. godine. Poznata je po tome što bi pojela svoja jajašca, usporila probavu i prestala jesti. Punoglavci su se u njenom stomaku razvijali tokom najmanje šest nedelja, a potom je mlade žabe „rađala“ kroz usta.
Rheobatrachus silus neobična je žaba koja je izumrla 1983. godine. Poznata je po tome što bi pojela svoja jajašca, usporila probavu i prestala jesti. Punoglavci su se u njenom stomaku razvijali tokom najmanje šest nedelja, a potom je mlade žabe „rađala“ kroz usta.
 Unatoč tome što su uzorci tkiva četrdesetak godina stajali u običnom zamrzivaču, stručni tim projekta ''Lazar'' iz njih je uspio izdvojiti ćelijska jezgra. Cilj spomenutog projekta jeste izumrlu žabu vratiti među živi svijet.Istraživači su se tokom pet godina koristili tehnikom transfera jezgara somatskih ćelija. Jezgra iz svežih jajašaca velike prugaste žabe, Mixophyes fasciolatus, zamenili su mrtvim jezgrima izumrle vrste. Neka su se jajašca počela spontano deliti i razvila su se u embrion – lopticu sastavljenu od živih ćelija koje se neprestano dele. Iako niti jedan embrion nije preživio duže od nekoliko dana, genetska testiranja dokazala su da se u ćelijama nalazio genetski materijal izumrle žabe.
Unatoč tome što su uzorci tkiva četrdesetak godina stajali u običnom zamrzivaču, stručni tim projekta ''Lazar'' iz njih je uspio izdvojiti ćelijska jezgra. Cilj spomenutog projekta jeste izumrlu žabu vratiti među živi svijet.Istraživači su se tokom pet godina koristili tehnikom transfera jezgara somatskih ćelija. Jezgra iz svežih jajašaca velike prugaste žabe, Mixophyes fasciolatus, zamenili su mrtvim jezgrima izumrle vrste. Neka su se jajašca počela spontano deliti i razvila su se u embrion – lopticu sastavljenu od živih ćelija koje se neprestano dele. Iako niti jedan embrion nije preživio duže od nekoliko dana, genetska testiranja dokazala su da se u ćelijama nalazio genetski materijal izumrle žabe.
Pomoć stotinama vrsta
„Gledamo kako se Lazar uzdiže iz mrtvih, a svaki je korak uzbudljiv“, rekao je vođa projekta Lazar, Mike Archer, profesor na Sveučilištu Novi Južni Wales u Sydneyju.
„Reaktivirali smo mrtve ćelije, pretvorili ih u žive i tako smo oživeli genom izumrle žablje vrste. Sada u kriogenim zamrzivačima imamo sveže ćelije koje možemo koristiti za daljnje kloniranje u našim eksperimentima. Sretni smo jer su preostale prepreke tehnološke, a ne biološke prirode pa smo sigurni da ćemo uspeti oživiti ovu vrstu. Važno je i to što smo uspeli dokazati potencijal koji ova tehnologija ima za zaštitu stotina ugroženih vrsta vodozemaca“, pojasnio je profesor.
Rezultati istraživanja tek će biti objavljeni. Profesor Archer o projektu Lazar prvi je puta javno govorio tek 15. matra ove godine na manifestaciji TEDx DeExtinction u Washingtonu. Spomenuo je i kako razmišlja kloniranjem oživiti i neke druge izumrle biljne i životinjske vrste. Mogući kandidati su tasmanijski tigar, mamut, ptica dodo, trobojna ara i novozelandska velika moa.
 Rheobatrachus silus neobična je žaba koja je izumrla 1983. godine. Poznata je po tome što bi pojela svoja jajašca, usporila probavu i prestala jesti. Punoglavci su se u njenom stomaku razvijali tokom najmanje šest nedelja, a potom je mlade žabe „rađala“ kroz usta.
Rheobatrachus silus neobična je žaba koja je izumrla 1983. godine. Poznata je po tome što bi pojela svoja jajašca, usporila probavu i prestala jesti. Punoglavci su se u njenom stomaku razvijali tokom najmanje šest nedelja, a potom je mlade žabe „rađala“ kroz usta. Unatoč tome što su uzorci tkiva četrdesetak godina stajali u običnom zamrzivaču, stručni tim projekta ''Lazar'' iz njih je uspio izdvojiti ćelijska jezgra. Cilj spomenutog projekta jeste izumrlu žabu vratiti među živi svijet.Istraživači su se tokom pet godina koristili tehnikom transfera jezgara somatskih ćelija. Jezgra iz svežih jajašaca velike prugaste žabe, Mixophyes fasciolatus, zamenili su mrtvim jezgrima izumrle vrste. Neka su se jajašca počela spontano deliti i razvila su se u embrion – lopticu sastavljenu od živih ćelija koje se neprestano dele. Iako niti jedan embrion nije preživio duže od nekoliko dana, genetska testiranja dokazala su da se u ćelijama nalazio genetski materijal izumrle žabe.
Unatoč tome što su uzorci tkiva četrdesetak godina stajali u običnom zamrzivaču, stručni tim projekta ''Lazar'' iz njih je uspio izdvojiti ćelijska jezgra. Cilj spomenutog projekta jeste izumrlu žabu vratiti među živi svijet.Istraživači su se tokom pet godina koristili tehnikom transfera jezgara somatskih ćelija. Jezgra iz svežih jajašaca velike prugaste žabe, Mixophyes fasciolatus, zamenili su mrtvim jezgrima izumrle vrste. Neka su se jajašca počela spontano deliti i razvila su se u embrion – lopticu sastavljenu od živih ćelija koje se neprestano dele. Iako niti jedan embrion nije preživio duže od nekoliko dana, genetska testiranja dokazala su da se u ćelijama nalazio genetski materijal izumrle žabe.Pomoć stotinama vrsta
„Gledamo kako se Lazar uzdiže iz mrtvih, a svaki je korak uzbudljiv“, rekao je vođa projekta Lazar, Mike Archer, profesor na Sveučilištu Novi Južni Wales u Sydneyju.
„Reaktivirali smo mrtve ćelije, pretvorili ih u žive i tako smo oživeli genom izumrle žablje vrste. Sada u kriogenim zamrzivačima imamo sveže ćelije koje možemo koristiti za daljnje kloniranje u našim eksperimentima. Sretni smo jer su preostale prepreke tehnološke, a ne biološke prirode pa smo sigurni da ćemo uspeti oživiti ovu vrstu. Važno je i to što smo uspeli dokazati potencijal koji ova tehnologija ima za zaštitu stotina ugroženih vrsta vodozemaca“, pojasnio je profesor.
Rezultati istraživanja tek će biti objavljeni. Profesor Archer o projektu Lazar prvi je puta javno govorio tek 15. matra ove godine na manifestaciji TEDx DeExtinction u Washingtonu. Spomenuo je i kako razmišlja kloniranjem oživiti i neke druge izumrle biljne i životinjske vrste. Mogući kandidati su tasmanijski tigar, mamut, ptica dodo, trobojna ara i novozelandska velika moa.













.jpg)